悈偺暘愅
峝搙偲偼悈偵娷傑傟傞僇儖僔僂儉偲儅僌僱僔僂儉偺崌寁検傪悢抣壔偟偨傕偺偱丄偙偺悢抣偑崅偄傕偺傪峝悈丄掅偄傕偺傪擃悈偲屇傇丅
壔妛帿揟1)偱偼丄僪僀僣峝搙偱峝搙10搙(CaCO3偵姺嶼偡傞偲178 mg/L)埲壓偼乽擃悈乿丄20搙埲忋傪乽峝悈乿(摨357 mg/L)丄偦偺娫傪乽拞娫偺悈(拞峝悈)乿偲暘椶偟偰偄傞丅
EDTA(僄僠儗儞僕傾儈儞巐恷巁)偼Ca2+側偳偺嬥懏梲僀僆儞偲1丗1偺嶖懱(僉儗乕僩嶖懱)傪嶌傞偺偱丄偙傟傪棙梡偟偰(僉儗乕僩揌掕)Ca2+丄Mg2+傪掕検丄偡側傢偪峝搙傪應掕偱偒傞丅
帋椏悈偵娷傑傟傞Ca2+偲Mg2+偼丄巜帵栻EBT偲愒巼怓偺嶖懱傪惗惉偡傞丅
偙偺梟塼偵EDTA傪揌壓偟偰偄偔偲 EDTA偼EBT傛傝傕嬥懏僀僆儞偲埨掕側嶖懱傪宍惉偡傞偺偱嬥懏EBT嶖懱偐傜嬥懏傪扗偄庢傝柍怓偺嬥懏EDTA嶖懱傪宍惉偡傞丅
偙偙偱梀棧偟偨EBT偼惵怓側偺偱梟塼偼廔揰偵嬤偔側傞偲惵傒傪懷傃偰偔傞丅
嬥懏僀僆儞傪M偲偡傞偲師偺傛偆偵偁傜傢偡偙偲偑偱偒傞丅
M-EBT + EDTA 仺 M-EDTA + EBT
(愒巼怓) (柍怓) (柍怓)丂 (惵怓)
廔揰偱偼梟塼拞偺M-EBT偑EDTA偵傛偭偰姰慡偵抲偒姺傢傞偺偱丄梟塼偼姰慡偵惵怓偵側傞丅
偙偺揌掕抣乮廔揰傑偱偵揌壓偟偨EDTA偺検乯偐傜Ca2+偲Mg2+偺擹搙傪媮傔埲壓偵弎傋傞傛偆偵悈偺慡峝搙偵姺嶼偡傞丅
傑偨丄暿偵帋椏傪偲傝丄pH=12偵偡傞偲EDTA偲Mg2+偼悈巁壔暔偲側傝EDTA偲斀墳偟側偄偺偱丄嬥懏巜帵栻NN傪梡偄偰Ca2+偺検偩偗傪媮傔摼傞丅
椉揌掕抣偺嵎偐傜Mg2+検傪嶼弌偡傞丅
仛幚尡偺庤弴仛
佱峝搙佲
嘆帋椏悈傪峝搙偵墳偠丄25 mL丄50 mL丄100 mL偺偄偢傟偐偺検(峝搙偑崅偄応崌偼25mL丄掅偄応崌偼100mL偲傞)傪丄儂乕儖僺儁僢僩傪梡偄偰惓妋偵僐僯僇儖價乕僇乕偵偲傞丅
嘇pH=10偺娚徴梟塼2 mL 壛偊傞丅(pH=10偺梟塼拞偱偼僇儖僔僂儉傕儅僌僱僔僂儉傕僀僆儞偺忬懺乮Ca2+偲Mg2+乯偱懚嵼偡傞偺偱丄椉曽偲傕僉儗乕僩傪惗惉偡傞丅
峝搙偑崅偄偲梊憐偝傟傞応崌丄pH=10偺娚徴梟塼傪壛偊傞偲HCO3亅亄OH亅佁CO32亅+H2O偺暯峵偑塃偵偐偨傛傝丄CO32亅偑憹壛偡傞丅
偙偺帪悈偵娷傑傟傞Ca2+偺検偑懡偄応崌丄CO32亅偲寢崌偟CaCO3偺敀怓捑揳偑惗偢傞丅
CaCO3偑惗偠傞偲丄梟塼偺拞偺Ca2+偺擹搙偑尭彮偡傞偨傔丄惓妋側峝搙傪媮傔傞偙偲偑偱偒側偄丅
偙偺栤戣傪夝寛偡傞偨傔偵偼丄偁傜偐偠傔梊旛帋尡傪偟偰丄偍偍傛偦偺EDTA偺昁梫検傪媮傔丄偙傟傛傝1乣5 mL掱搙偡偔側偄EDTA検傪帋椏偵傑偢揧壛偡傞(偙傟偵傛傝丄偁傜偐偠傔Ca2+偲EDTA偺僉儗乕僩嶖懱傪惗惉偝偣CO32亅偑憹偊偰傕CaCO3偑捑揳偟側偔側傞)丅偦偺偁偲埲壓偺憖嶌傪峴偆偙偲偲偡傞丅)
嘊EBT巜帵栻1乣2揌傪壛偊傞丅
嘋怳傝崿偤側偑傜EDTA昗弨梟塼偱揌掕偡傞丅
丂EBT巜帵栻偺愒怓偑惵怓偲側傝丄愒傒偑側偔側偭偨帪偑廔揰偱偁傞丅3夞偺揌掕偺暯嬒傪偲傞丅
佱Ca2+佲
嘆帋椏悈傪峝搙偵墳偠丄25 mL丄50 mL丄100 mL偺偄偢傟偐傪慖戰偟丄儂乕儖僺儁僢僩傪梡偄偰僐僯僇儖價乕僇乕偵偲傞丅
嘇6 mL/L KOH梟塼4 mL(pH=12偱偼儅僌僱僔僂儉偼悈巁壔暔Mg(OH)2偵側傝丄僉儗乕僩傪惗惉偟側偄丅)傪壛偊偰傛偔怳傝崿偤丄1暘娫曻抲偡傞丅
嘊NN巜帵栻0.1 g傪壛偊丄EDTA昗弨梟塼偱NN巜帵栻偺愒怓偑惵怓偲側傝丄愒傒偑側偔側偭偨帪偑廔揰偱偁傞丅3夞偺揌掕偺暯嬒傪偲傞丅
仛寢壥偺張棟俀乯偲寢壥仛
峝搙偼悈拞偵懚嵼偡傞僇儖僔僂儉僀僆儞偲儅僌僱僔僂儉僀僆儞偺崌寁暔幙検偲摍偟偄暔幙検偺扽巁僇儖僔僂儉CaCO3偺幙検偵姺嶼偟丄mg/L傪扨埵偱昞偟偨傕偺偱偁傞丅
EDTA偺1暘巕偼1屄偺Ca2+偁傞偄偼Mg2+偲嶖懱傪嶌傞偺偱丄Ca2+丄Mg2+偺幃検傪峫偊傞偲丄
0.01 M EDTA 1 mL 亖 0.01 M CaCO3 1 mL 亖 1.001 mg CaCO3
0.01 M EDTA 1 mL 亖 0.01 M Ca2+ 1 m L 亖 0.4008 mg Ca2+
亖 0.01 M Mg2+ 1 mL 亖 0.243 mg Mg2+
EDTA偺僼傽僋僞乕丒丒丒f
Ca2+偲Mg2+偺揌掕偵偍偗傞帋椏悈検 丒丒丒V mL
Ca2+偲Mg2+偺揌掕偵梫偟偨EDTA梟塼丒丒丒 b mL
Ca2+偺揌掕偵偍偗傞帋椏悈検丒丒丒VCa mL
Ca2+偺揌掕偵梫偟偨EDTA梟塼丒丒丒a mL
廬偭偰塃偺傛偆偵暥帤傪抲偔偲壓偺傛偆偵側傞丅
峝搙(CaCO3 mg/L)=b亊1000/V亊1.001亊f
丂丂丂丂丂丂
Ca2+mg/L=a亊1000/VCa亊0.401亊f
丂丂丂丂丂丂
Mg2+mg/L=(b/V-a/VCa)亊1000亊0.243亊f
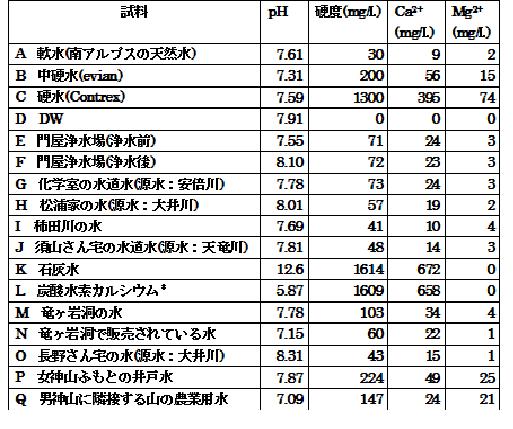
17庬偺悈傪帋椏偲偟丄僉儗乕僩揌掕朄傪峴偄丄峝搙偲Ca2+丄Mg2+偺検傪寛掕偟偨丅偦偺寢壥傪昞1偵帵偡丅
昞1丂條乆側悈偺暘愅寢壥
仛峫嶡仛
A乣C偺寢壥偐傜丄傗偼傝峝搙偵偼戝偒側嵎偑偁傞偙偲偑暘偐偭偨丅
D偼僀僆儞岎姺庽帀傪捠偟偨屻偵忲棷張棟傪偟偰偍傝丄柍婡暔僀僆儞帺懱娷傑傟偰偄側偄偨傔丄峝搙0偲偄偆寢壥偵側偭偨丅
G乣J丄O偺寢壥偐傜丄導撪偺悈偼慡偰擃悈偱偁傞偲偄偆偙偲偑暘偐傞丅
偙傟偑忩悈嶌梡偵傛傞塭嬁偐偳偆偐妋偐傔傞偨傔偵丄忩悈慜屻偺悈傪暘愅偟偨偲偙傠丄E乣G偵帵偡傛偆偵丄偺寢壥偐傜丄忩悈慜偐傜杮妛壔妛幚尡幒偵攝悈偝傟偰偔傞傑偱偵峝搙丄Ca2+丄Mg2+偺抣偵曄壔偼側偔丄忩悈嶌梡偵傛傞塭嬁偼側偄偲峫偊傜傟傞丅
傛偭偰丄悈摴悈傪挷傋傟偽丄偦偺尨悈偺惈幙偑暘偐傞偲偄偆偙偲偑尵偊傞丅
導撪偵偼峝搙偑崅偄悈傪摼傞偙偲偑偱偒側偄偺偐峫偊偨強丄愇奃娾懱偱偁傞忂擕摯偲抝恄丒彈恄嶳廃曈偺悈偼CaCO3偺塭嬁偺偨傔峝搙偑崅偔側傞偲梊憐偟偨丅
M偺寢壥偐傜愇奃娾懱偱偁傞棾儢娾摯偺悈偼擃悈偵暘椶偝傟傞偑斾妑揑峝搙偼崅偄丅
偙傟偼傗偼傝愇奃娾偵怗傟傞婡夛偑懡偄偨傔偱偁傞偲峫偊傞丅
N偺寢壥偐傜丄棾儢娾摯偺悈傪張棟偟偰斕攧偝傟偰偄傞悈偱偼丄峝搙偑掅偔丄側偍偐偮Ca2+偺検偑懡偄偨傔丄寬峃偵椙偔丄偍偄偟偄悈偲尵傢傟偰偄傞棟桼偑椙偔暘偐偭偨丅
P偲Q偺寢壥偐傜丄愇奃娾偺塭嬁偵傛傝悈偺峝搙偼崅偔丄傑偨偦偺嬤偔偺擾嬈梡悈傕塭嬁傪庴偗偰偄傞偙偲偑傢偐傞丅
栠傞

